تست وسترن بلات
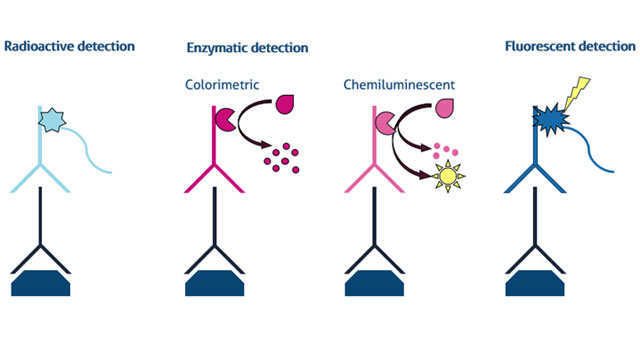
تست وسترن بلات به نام های ایمونوبلاتینگ و پروتئین بلاتینگ معروف است و یکی از تکنیک های مهم در زیست شناسی سلولی و مولکولی می باشد. وسترن بلات یک تکنیک مرسوم در آزمایشگاه های مولکولی و بیوشیمی است که برای جداسازی و شناسایی پروتیین های خاص در نمونه خون یا بافت استفاده می شود و این جداسازی بر پایه وزن مولکولی است، که برای ارزیابی اندازه پروتئین مورد نظر و اندازه گیری میزان بیان پروتئین استفاده می شود.این روش شامل استفاده از الکتروفورز ژل برای جداسازی پروتئین های نمونه است. پروتئین های جداشده از ژل به سطح غشا منتقل می شوند. غشاء در معرض آنتی بادی مخصوص پروتئین قرار می گیرد. اتصال آنتی بادی با استفاده از یک برچسب رادیواکتیو یا شیمیایی تشخیص داده می شود.
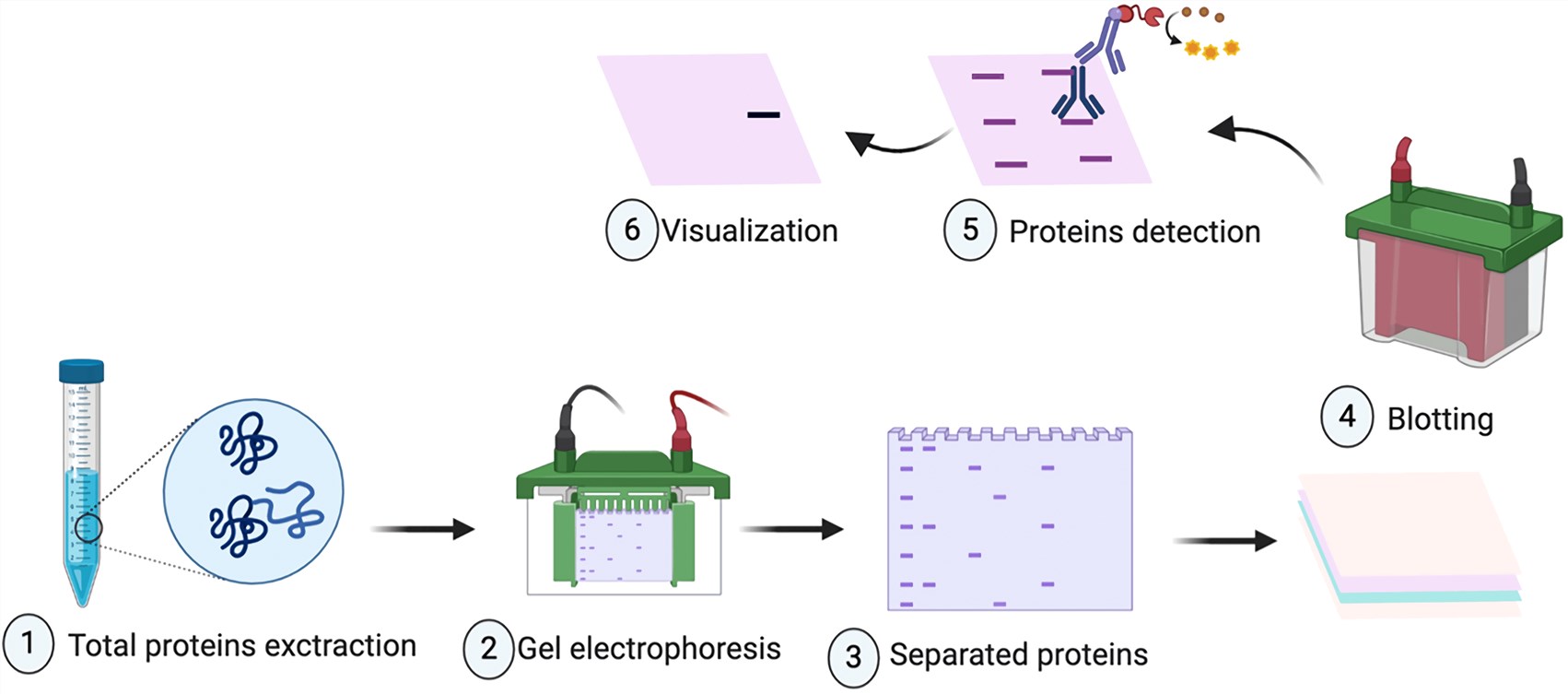
مراحل اصلی تست وسترن بلات به شرح زیر است:
- جداسازی پروتئین ها بر اساس اندازه با استفاده از SDS- PAGE
- انتقال پروتئین ها از ژل به غشا نیتروسلولز به وسیله جریان الکتریسته
- شناسایی پروتیین های هدف با استفاده از آنتی بادی های اولیه و ثانویه مناسب
- تحلیل نتایج با استفاده از تجهیزات تصویربرداری
شرکت درمان نگار وارد کنند انواع دستگاه های تصویربرداری در این زمینه از جمله برند syngene می باشد.
پروتئین ها کاملا با DNA و RNA تفاوت دارند؛ در روشی به نام ایمنوبلاتینگ می توان یک پروتئین ویژه را از میان هزاران پروتئین دیگر مشخص کرد. این روش از نظر مفهومی همانند روش هیبریداسیون ساترن و نورترن است. در واقع نام دیگر ایمونوبلاتینگ، نقطه گذاری وسترن است که موید شباهت آن به تکنیک های مذکور می باشد.
در این روش ابتدا پروتئین های درون ژل با کوماسی بلو رنگ آمیزی می شود. مرسوم ترین روش برای مشاهده پروتئین ها درون غشاء ایمونوبلات (وسترن بلات) می باشد. در این حالت از قدرت میدان الکتروفورز و اختصاصیت آنتی بادی استفاده می شود. دو آنتی بادی در این روش وسترن بلات استفاده می شود. یکی از آنها اختصاصی پروتئین، دومین آنتی بادی به اولین آنتی بادی اتصال دارد و به آنزیمی که برای شناسایی اولین آنتی بادی مورد استفاده قرار می گیرد، متصل می شود. آنزیم فوق محصول رنگی تولید می کند یا در طی فرایند کمولومینسانس نور تولید می کند. در وسترن بلات ابتدا مخلوط پروتئینی، الکتروفورز شده و از ژل به غشای منفذ دار منتقل می گردد. جنس غشا به دلیل سرعت بالا در انتقال از نیتروسلولز یا پلی- وینیلین دی فلوراید است.کاغذ به دلیل ویژگی اتصال به پروتئین های سنگین تر بیشتر قابل استفاده می باشد. انتقال پروتئین ها از ژل به غشا به ماهیت ژل، جرم مولکولی پروتئین های منتقل شده و غشا مورد نظر بستگی دارد.
همانند نقطه گذاری ساترن، پروتئین ها به گونه ای به غشا منتقل می شوند که موقعیت آنها روی غشاء تصویر آینه ای موقعیت آنها در ژل اصلی است. همانند سایر تکنیک های نقطه گذاری هنگامی که پروتئین به غشا متصل می شوند، تمامی جایگاههای اتصال غیراختصاصی باقی مانده مسدود می شوند. این کار با محلولی از پروتئین های غیرمرتبط با پروتئین های مورد مطالعه ( اغلب از شیرخشک استفاده می شود که دارای پروتئین آلبومین است) انجام می شود. سپس غشاء در محلولی از پادتن که به طور اختصاصی پروتئین مورد نظر را شناسایی می کند، انکوبه می گردد. پادتن ها در صورتی می توانند به غشاء متصل شوند که هدف پروتئینی خود را روی غشا بیابند. در نهایت از یک آنزیم ایجاد کننده رنگ که به طور مصنوعی به پادتن متصل می شود (پادتن دومی که به پادتن اول متصل می شود) استفاده می گردد تا پادتن های متصل به غشا قابل مشاهده شوند.
مراحل انجام تکنیک وسترن بلاتینگ شامل مراحل زیر می باشد:
استخراج پروتئین از نمونه :
- در ابتدا به نمونه بیولوژیکی در داخل ظرف کشت (در محیط سرد قرار گرفته) بافر فسفات سالین ( PBS) اضافه کنید.
- نمونه را داخل لوله های میکروسانتریفیوژ بریزید وبه مدت 5 دقیقه با دور 1500 در دستگاه میکروسانتریفیوژ قرار داده و مایع رویی جداشده را خارج کنید.
- در ادامه کار 180 ماکرولیتر بافر لیز کننده سلول به همراه 20 ماکرولیتر پروتئاز به لوله اضافه کنید. سپس به مدت 30 دقیقه با درجه دمایی پایین داخل انکوباتور قرار دهید. سپس به مدت 10 دقیقه در دمای 4 درجه سانتیگراد با دور 12000 RPM سانتریفیوژ کنید.
- در مرحله آخر مایع رویی در لوله ای دیگر ریخته و در دمای پایین نگهداری کنید. در انتها غلضت پروتئین با استفاده از دستگاه اسپکتروفتومتر اندازه گیری کنید.
ژل الکتروفورز:
الکتروفورز در این روش به وسیله ژل پلی آکریل آمید و سدیم دودسیل سولفات (SDS-PAGE) انجام می شود. پروتئین در ابتدا توسط دترجنت آنیونی سدیم دودسیل سولفات دناتوره می شود و الکتروفورز با ژل پلی آکریل آمید انجام می شود به دلیل وجود دترجنت آنیونیSDS) (بار همه پروتئین ها منفی می شود و جداسازی بر اساس اندازه پروتئین ها صورت می گیرد و سرعت عبور پروتئین با اندازه آن رابطه عکس دارد در واقع هرچه اندازه پروتئین کوچک تر باشد با سرعت بیشتری از ژل عبور می کند و بالعکس.
انتقال از ژل به صفحات نیتروسلولزی:
در این مرحله از وسترن بلات تست و ژل بین صفحات نیتروسلولزی قرار می گیرد در ادامه ژل به همراه صفحات نیتروسلولزی در داخل cassette و در درون تانک الکتروفورز قرار می دهیم، زمانی که میدان الکتریکی در داخل الکتروفورز برقرار می شود پروتئین ها از ژل جداشده و وارد صفحات نیتروسلولزی می شود.
شناسایی پروتئین های هدف با استفاده از آنتی بادی:
در تکنیک وسترن بلات، ابتدا آنتی بادی اولیه به صفحه متصل شده سپس آنتی بادی نشاندار به آنتی بادی اولیه متصل می شود. بدین صورت است که با شناسایی آنتی ژن سطحی پروتئین هدف توسط آنتی بادی، پروتئین مورد نظر شناسایی می گردد.
تشخیص تعدادی از بیماری ها با استفاده از تست ایمونوبلاتینگ
- تایید حضور ویروس HIV
- تشخیص بیماری جنون گاوی BSE
- تشخیص بیماری تب خرگوش به دلیل باکتری فرانسیسلا تولرانسیس Francisella tularensis ایجاد می شود.
- برخی از اشکال بیماری لایم
- تایید هپاتیتB
- تایید هرپس ویروس HSV-2
- تشخیص بیماریHTLV
نکاتی مهم در ارتباط با تکنیک وسترن بلات:
- همانطور که اشاره کردیم تست وسترن بلات دارای تعداد قابل توجهی مراحل است. این فرآیند طولانی، زمان و هزینه مورد نیاز برای نتایج دقیق را افزایش می دهد. با این حال، بر خلاف ELISA، وسترن بلات کمتر احتمال دارد که نتایج مثبت کاذب بدهد، به ویژه در تشخیص ویروس نقص ایمنی انسانی (HIV).
- تکنیک وسترن بلات برای تشخیص آنتی بادی های ضد HIV در نمونه های سرم و ادرار انسان استفاده می شود. نمونه های پروتئینی از یک فرد شناخته شده آلوده به HIV با الکتروفورز جدا شده و سپس روی غشای نیتروسلولوز لکه می شود. سپس یک آنتی بادی خاص برای تشخیص پروتئین چسبانده می شود. وسترن بلات معمولاً پس از آزمایش الایزا برای تأیید تشخیص HIV انجام می شود. این تست بسیار حساس تر از تست الایزا است. اخیراً، در کیتهای تجاری وسترن بلات HIV، پروتئینهای ویروسی به غشاء چسبانده میشوند. آنتیبادیهای نمونههای ادرار یا سرم انسان به این پروتئینها متصل میشوند و آنتیبادیهای ضد HIV برای شناسایی نوارها در کنار کنترلهای کیفیت استفاده میشوند.
- روش وسترن بلات وجود یا عدم وجود، اندازه و فراوانی پروتئین های هدف را در یک نمونه تعیین می کند که به دلایل علمی مختلف در بسیاری از زمینه های مطالعاتی مفید است. در این راستا، این تکنیک برای ارزیابی موارد زیر مفید است: برهمکنش های پروتئین-DNA، برهمکنش های پروتئین-پروتئین، تغییرات پس از ترجمه (PTMs)، تشخیص ایزوفرم پروتئین، خصوصیات آنتی بادی، نقشه برداری اپی توپ، و محلی سازی پروتئین درون سلولی.
- از آنجایی که تست وسترن بلات یک روش مبتنی بر آنتی بادی است، این تکنیک اغلب برای تشخیص بیماریهای غیر عفونی با استفاده از غربالگری با توان بالا، نتایج قابل اعتمادی را پشتیبانی میکند و تولید میکند. به عنوان مثال، هنگام تعیین سرطان، ایزوفرم های نامتجانس پروتئین ها می توانند به نشانگرهای بالقوه آسیب شناسی بیماری تبدیل شوند. اتوآنتی بادی ها همچنین ممکن است نشان دهنده یک بیماری خودایمنی باشند.
- برخی از پروتئینها از طریق شبیهسازی مولکولی مهندسی شدهاند تا حاوی توالیهای کوتاهی از اسیدهای آمینه باشند که به عنوان برچسب عمل میکنند. تگ های رایج شامل تگ HA و تگ Myc است. این برچسب ها به عنوان یک اپی توپ پروتئین خارجی عمل می کنند که به طور طبیعی در سیستم بیولوژیکی مورد مطالعه وجود ندارد. بنابراین، برچسب تشخیص پروتئین را آسان تر از سایر پروتئین های طبیعی می کند. یک آنتی بادی که به تگ هدایت می شود، حضور و مقدار پروتئین برچسب گذاری شده را در وسترن بلات شناسایی می کند.