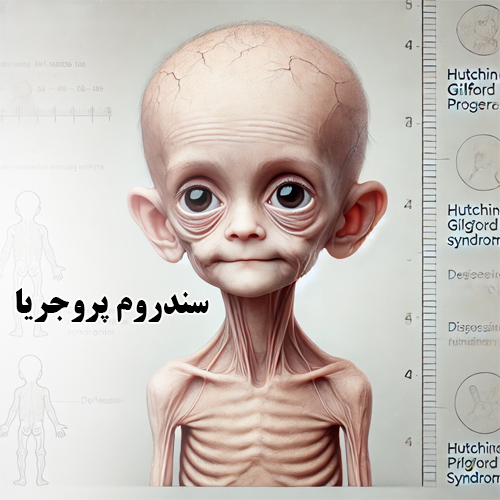
سندروم پیری زودرس یا پروجریا
پیری زودرس به عنوان سندروم پروجریا هاچینسون گیلفورد (HGPS) یا (پروگریا) شناخته می شود, یک اختلال ژنتیکی بسیار نادر و پیشرونده است. این باعث می شود که کودکان از دو سال اول زندگی خود به سرعت پیر شوند.کودکان با پروجریا معمولا در بدو تولد سالم به نظر می رسند. در طول سال اول با علائمی مانند کند شدن رشد، از دست دادن بافت چربی و ریزش مو ظاهر می شود. مشکلات قلبی یا سکته علت نهایی مرگ در اکثر کودکان مبتلا به پروجریا است.
میانگین امید به زندگی برای کودک مبتلا به پروجریا در حدود 15 سال است. برخی از مبتلایان به این عارضه ممکن است جوانتر بمیرند و برخی دیگر طولانی تر, حتی تا 20 سال عمر کنند. با توجه به بنیادهای تحقیقاتی پروگریا، تخمین زده می شود که نسبتاً 350 تا 400 کودک در سراسر جهان بدون توجه به جنسیت و نژاد با پروگریا زندگی می کنند. تقریباً از هر 20 میلیون نفر 1 نفر را تحت تأثیر قرار می دهد.
هیچ درمانی برای پروگریا وجود ندارد، اما درمانها و تحقیقات جدید نویدبخش مدیریت علائم و عوارض بیماری هستند.این بیماری در اثر جهش در ژن LMNA (پروتئین لامین A) در کروموزوم 1 ایجاد می شود. شکل جهش یافته لامین A معمولاً به عنوان پروگرین شناخته می شود. یکی از نویسندگان، لزلی گوردون، پزشکی بود که هیچ چیز در مورد پروجریا نمیدانست تا اینکه پسر خودش، سم، در ۲۲ ماهگی با این بیماری تشخیص داده شد.
این ژن که به نام لامین A (LMNA) شناخته می شود، پروتئینی را می سازد که ساختار اسکلتی هسته سلولی را ایجاد می کند.هنگامی که ژن LMNA تغییر می کند، یک پروتئین لامین A معیوب به نام پروگرین ساخته می شود. پروگرین سلول ها را ناپایدار می کند و به نظر می رسد که منجر به روند پیری پروجریا می شود.
گزارشی در سال 2003 در نیچر بیان کرد که پروجریا ممکن است یک صفت غالب دنوو (جدید) باشد. در طی تقسیم سلولی در زیگوت یا در گامت های یکی از والدین ایجاد می شود. سندروم پروجریا هاچینسون گیلفورد (HGPS) یک بیماری پیری زودرس است که شامل جهش های ژنتیکی می شود, منجر به تضعیف ویژگی های فنوتیپی می شود.
وضعیت فعلی دانش در زمینه مسیرهای مولکولی به پاتوفیزیولوژی HGPS کمک می کنند. ناهنجاری های مورفولوژیکی هسته ای, بیان نامنظم ژن, نقص در ترمیم DNA , کوتاهی تلومر و ناپایداری ژنومی همه ناشی از تجمع پروتیئن سمی پروگرین هستند که تواتایی تکثیر سلولی را مختل می کند.
ژنتیک بیماری پروجریا :
بیماری پروجریا با الگوی خانوادگی به ارث نمی رسد یک اختلال اتوزومال غالب است توسط جهش های نقطه ایde novo ژن LMNA در کدون 608 اگزون 11 روی کروموزوم 1 ایجاد میشود.
ژن LMNA سه جزء لایههای هستهای را رمزگذاری میکند که پروتئینهایی به نامهای لامین A (LA)، لامین C (LC) و لامین 10 هستند که پروتئین های سازنده غشاء داخلی هسته می باشند.
اکنون ثابت شده است هرکدام از لامین ها نقش مهمی در تقسیم سلولی، سازماندهی کروماتین، همانندسازی DNA، شکل هسته و رونویسی دارد.
تقریباً تمام موارد پروجریا به عنوان یک جهش جدید و خود به خود (de novo) در ژن LMNA رخ می دهد. این بدان معناست که هیچ سابقه خانوادگی بیولوژیکی این بیماری وجود ندارد. از والدین به ارث نمی رسد. جهش تقریباً همیشه قبل از لقاح در سلول اسپرم رخ می دهد.
در اینجا عوامل کلیدی دخیل در توسعه و پیشرفت HGPS آمده است:
· جهش ژن LMNA: علت اصلی HGPS جهش در ژن LMNA است که منجر به تولید پروتئین غیر طبیعی به نام پروگرین می شود.
· تجمع پروگرین: پروتئین غیرطبیعی پروگرین در داخل سلول ها تجمع می یابد و منجر به اختلال عملکرد سلولی می شود.
· نقصهای پوشش هستهای: پروگرین باعث ایجاد نقصهای ساختاری در پوشش هستهای میشود که بر پایداری و یکپارچگی هسته سلول تأثیر میگذارد.
· بی ثباتی ژنومی: وجود پروگرین منجر به بی ثباتی در ژنوم می شود و به تسریع پیری کمک می کند.
· پیری سلولی: سلولهایی با سطوح بالای پروگرین وارد مرحله پیری میشوند، جایی که تقسیم نمیشوند و به درستی عمل میکنند.
· کوتاه شدن تلومر: کوتاه شدن سریع تلومرها، کلاهک های محافظ انتهای کروموزوم ها، منجر به پیری زودرس و مرگ سلولی می شود.
· اختلال عملکرد میتوکندری: آسیب ناشی از پروگرین به میتوکندری منجر به کاهش تولید انرژی سلولی و افزایش استرس اکسیداتیو می شود.
· از دست دادن پروتئوستاز: پروتئین غیر طبیعی تعادل سنتز و تجزیه پروتئین را مختل می کند و منجر به تجمع پروتئین های آسیب دیده می شود.
· التهاب مزمن: التهاب مداوم ناشی از استرس و آسیب سلولی، انحطاط بافت را تسریع می کند.
· کاهش سلول های بنیادی: فرسودگی سلول های بنیادی توانایی بدن برای ترمیم و بازسازی بافت ها را کاهش می دهد و به علائم HGPS کمک می کند.
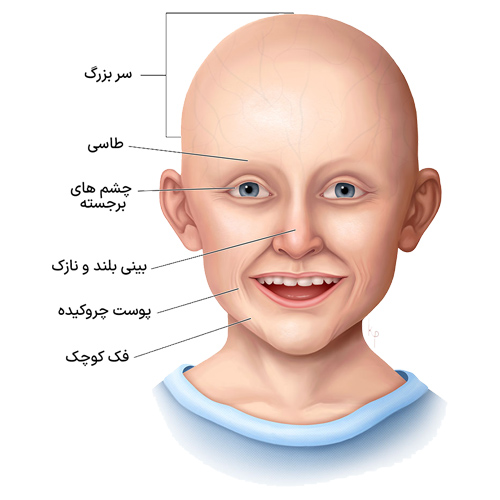
علائم سندروم پیری زودرس عبارتند از:
· کندی رشد و افزایش وزن ضعیف با قد و وزن کمتر از حد متوسط
· کمبود چربی که درست در زیر پوست ذخیره شده است.
· بزرگی سر در مقایسه با صورت
· فک کوچک، چانه و دهان و لب های نازک.
· بینی نازک و خمیده با یک قلاب کوچک در انتهای آن که ممکن است شبیه منقار پرنده باشد.
· چشم ها و پلک های بزرگ که کاملا بسته نمی شوند.
· ریزش مو از جمله مژه و ابرو.
· پوست نازک، لکه دار و چروکیده.
· سیاهرگ ها به راحتی از طریق پوست دیده می شوند.
· صدای بلند.
· پیری زودرس.
سندروم پروجریا چگونه تشخیص داده می شود:
پزشک کودک ابتدا معاینه فیزیکی انجام می دهد, اگر مشکوک به ابتلای بیماری پروجریا شوند , آزمایش خون برای بررسی جهش در ژن خاص مسئول این اختلال است تجویز می شود.
۱۰ علت مهم از مجموعه دلایل ابتلا به سندروم پیری زودرس عبارت اند از:
1. جهش ژنتیک: پیری زودرس بیشتر به دلیل جهش در ژن LMNA اتفاق میافتد که نقص در تولید پروتئینهای هستهای را ایجاد میکند.
2. وراثت: اگر یک فرد والدینی با جهش ژن LMNA را داشته باشد، احتمال انتقال این جهش و ابتلا به پیری زودرس در فرزندان افزایش مییابد.
3. عوامل محیطی: برخی عوامل محیطی ممکن است در تأثیرگذاری بر بروز پیری زودرس نقش داشته باشند، اما نقش آنها نهایی هنوز مشخص نشده است.
4. تحولات سلولی: اختلالات در تعداد و عملکرد سلولها ممکن است باعث شدت بیشتر این بیماری شوند.
5. تأثیرات هورمونی: تنظیم ناپذیری هورمونها و تغییرات در سطح آنها ممکن است در پیری زودرس نقش داشته باشد.
6. فشار و استرس: محیطهای استرسزا و فشارهای روانی ممکن است بر عملکرد سلولها تأثیر گذار باشند.
7. نقص در بازیابی DNA: نقص در فعالیت سیستم DNA ممکن است باعث تجمع ایرادات ژنتیکی شود.
8. عوامل التهابی: التهابات مزمن و پاسخهای التهابی غیرطبیعی ممکن است در پروسههای پیری زودرس نقش داشته باشند.
9. فعالیت اکسیداتیو: استرس اکسیداتیو که ناشی از آسیبهای مولکولی در سلولها است، ممکن است در پیری زودرس تأثیرگذار باشد.
10. نقص در ساختار سلولی و بافتی: نقص در ساختار سلولها و بافتها میتواند به ناپایداری و آسیب پذیری آنها منجر شود و در نهایت به پیری زودرس منجر گردد.
سندرم های دیگری نیز وجود دارند که ممکن است شامل مشکلاتی با پروتئین های شبه پروگرین باشند به این شرایط سندرم پروژروئید می گویند. ژن های تغییر یافته که باعث ایجاد این سندرم ها می شوند در خانواده ها منتقل می شوند. آنها باعث پیری سریع و کوتاه شدن طول عمر می شوند:
- سندرم Wiedemann-Rautenstrauch که به عنوان سندرم پروژروئید نوزادی نیز شناخته می شود، در رحم شروع می شود و علائم پیری در بدو تولد آشکار می شود.
- سندرم ورنر، همچنین به عنوان پروجری بزرگسالان شناخته می شود، در سال های نوجوانی یا اوایل بزرگسالی شروع می شود. باعث پیری زودرس و بیماری هایی مانند آب مروارید و دیابت در سنین بالا می شود.
درمان بیماری:
هیچ درمانی برای پروگریا وجود ندارد، اما درمان هایی مانند داروی لونافارنیب می تواند به مدیریت علائم و کند کردن پیشرفت بیماری کمک کند.
دختر معروف مبتلا به پروجریا کیست؟
هیلی لین اوکینز (3 دسامبر 1997 – 2 آوریل 2015) نویسنده و فعال انگلیسی بود که از بیماری بسیار نادر پیری پروجریا رنج می برد.
آزمایش های ژنتیک برای تشخیص بیماری کدامند؟
آزمایش ژنتیک ابزاری قدرتمند برای تشخیص بیماری ها با بررسی تغییرات DNA شما است. در اینجا برخی از انواع آزمایشات ژنتیکی رایج که برای تشخیص بیماری استفاده می شوند آورده شده است:
· آزمایش تک ژنی: به دنبال جهش در یک ژن خاص مرتبط با یک بیماری خاص، مانند فیبروز کیستیک یا بیماری سلول داسی شکل است.
· پانلهای آزمایش ژنتیک: آزمایشهایی برای تشخیص جهش در ژنهای متعددی که میتوانند مسئول بیماریهایی مانند نقص ایمنی اولیه یا صرع باشند.
· توالی یابی کل Exome: تمام مناطق کد کننده پروتئین ژن های شما را برای شناسایی جهش هایی که ممکن است باعث بیماری شوند، تجزیه و تحلیل می کند.
· توالییابی کل ژنوم: کل کد ژنتیکی شما را بررسی میکند تا جهشهایی را که میتوانند با شرایط سلامت مرتبط باشند، شناسایی کند.
· آزمایش فارماکوژنتیک: تعیین می کند که چگونه ترکیب ژنتیکی شما بر پاسخ شما به داروها تأثیر می گذارد و به شخصی سازی برنامه های درمانی کمک می کند.